Перитонеальные клетки перитонеальной полости крыс как система для моделирования ответов иммунной системы на действие радиационного фактора
Перитонеальная или брюшинная полость (cavitas peritonei) находится в абдоминальной области, ограничена мембраной, выстлана мезотелием и содержит небольшое число серозной жидкости – специфического секрета, который увлажняет брюшину, что обеспечивает свободное движенье соприкасающихся органов. В полости находятся печень, селезёнка, большая часть ЖКТ и другие внутренние органы. Близость ЖКТ с его содержимым и огромной массой микроорганизмов определяет необходимость тщательного иммунного надзора. Роль первичного барьера выполняют слизистая кишечника (эпителий и лимфоидная ткань), а перитонеальная полость и печень роль следующего уровня защиты. Перитонеальная полость крыс содержит относительно большое количество клеток иммунной системы (3-8*107 кл.), включая макрофаги. Наличие большого количества наивных макрофагов вместе с простотой получения клеток перитонеальной полости определяет её, как основной источник для получения популяции резидентных тканевых макрофагов [1]. Многообразие биологических реакций этих клеток, а также их участие во многих физиологических и патофизиологических процессах определяет их, как перспективную мишень для разработки новых методов лечения ряда тяжелых заболеваний. Тканевые фагоциты участвуют в формировании реакции тканей на воздействие ионизирующих излучений [2, 3], ультрафиолетового излучения и неионизирующих электромагнитных полей промышленной частоты [4], сотовой связи [5]. Основным механизмом их участия в патологических процессах являются воспалительные реакции, сопровождающиеся усилением продукции активных форм кислородо и азота [3, 6]. Эти изменения ассоциированы с развитием геномной нестабильности. Также рядом работ показано участие тканевых фагоцитов в процессах старения, канцерогенеза [7], генезе болезней системы кровообращения.
Остановимся немного подробнее на клеточном составе серозной жидкости перитонеальной полости. Клетки перитонеальной полости — это гетерогенная популяция, имеющая видовые особенности [8, 9]. Резидентная клеточная популяция перитонеальной полости крыс Вистар представлена лимфоцитами, макрофагами и тучными клетками в приблизительно равных пропорциях. Дифференцировку удобно проводить по уровню экспрессии α-цепей интегринов CR3 и CR4, которые распознаются антителами против CD11b/c (см. рисунок 1). Максимальная экспрессия характерна для макрофагов и гранулоцитов, низкий уровень экспрессии для CD3— клеток (B клетки) и отсутствие экспрессии для CD3+ клеток (T-клетки), а также клеток, несущих рецептор NKR-P1A (NK и NKT клетки).
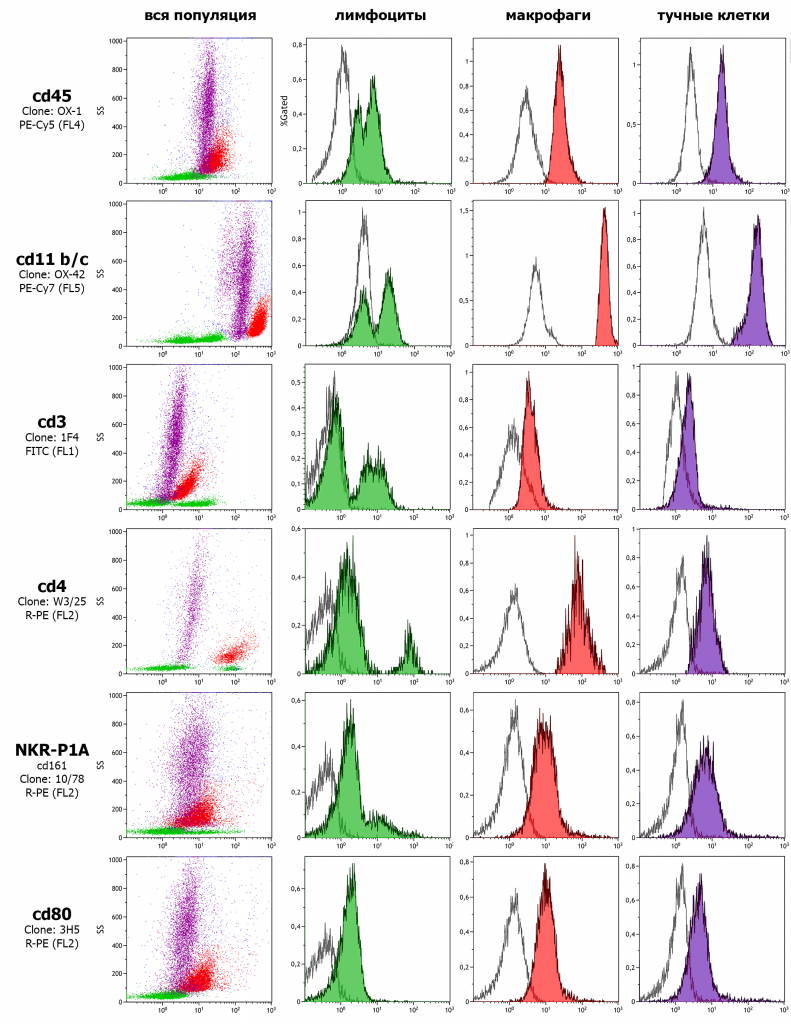
Рисунок 1 – Иммунофенотипическая характеристика клеток перитонеальной полости крыс Вистар. Гистограмма распределения клеток по интенсивности флуоресцентного сигнала демонстрирует существенные различия по ряду поверхностных антигенов кластера дифференцировки лимфоцитов (CD) для лимфоцитов (зеленый), макрофагов (красный) и базофильных гранулоцитов (фиолетовый) перитонеальной полости. Изотипический контроль для каждого типа клеток представлен в виде неокрашенной гистограммы.
Популяция резидентных макрофагов характеризуется высоким уровнем экспрессии рецепторов CD11b/c, участвующих в поглощении опсонизированных агентов и реакции клеток на продукт альтернативной активации комплемента C3bi. Уровень экспрессии общего лейкоцитарного антигена CD45 (тирозиновая протеинфосфатаза C рецепторного типа) этими клетками превышает данный показатель для лимфоцитов ПП, что отличает резидентную популяцию клеток ПП от пула периферической крови, где соотношение обратное. В популяции тучных клеток ПП крыс, определённой по параметрам бокового светорассеяния и экспрессии этого маркера выявляется немногим более 10 % клеток со сниженной экспрессией CD11b/c. Эти клетки несколько крупнее основной популяции гранулоцитов ПП по показателю прямого светорассеивания и демонстрируют тенденцию к снижению сигнала CD45, CD3, CD80, NKR-P1A.
Как видно из данных представленных на рисунке 2, более половины лимфоцитов ПП (20 % от общего количества перитонеальных клеток) составляют B-клетки для них характерно отсутствие экспрессии CD3, CD4, CD80 и NKR. Однако они несут на поверхности антигенный домен общий для α-цепей интегринов CR3 и CR4. По литературным данным для B-клеток человека и мыши — это рецептор комплимента Мас-1 представляющий собой димер CD11b/CD18. Также эти клетки демонстрируют более высокий уровень сигнала CD45. Среди них выделяют две важные субпопуляции B1 и B2 по экспрессии CD45RA(b220), CD5 и иммуноглобулинов различных изотипов [10].
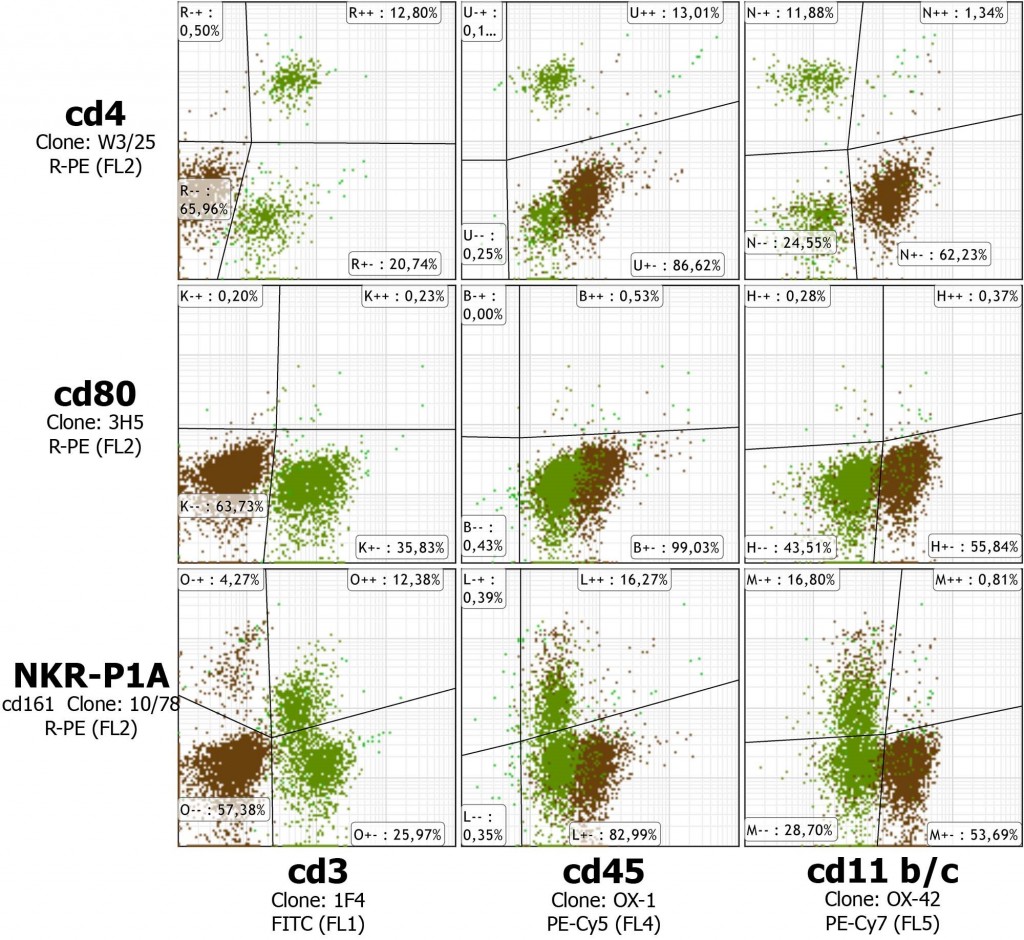
Рисунок 2 – Иммунофенотипическая характеристика лимфоцитов перитонеальной полости крыс Вистар. Скатерограммы распределения клеток по интенсивности флуоресцентного сигнала демонстрируют наличие основных субпопуляций лимфоцитов среди клеток перитонеальной полости. * Для анализа взяты клетки с низким показателем бокового светорассеивания (SS) и уровня экспрессии CD11b/c. Коричневым цветом обозначены CD3— клетки, а зелёным CD3+.
Среди лимфоцитов ПП доля Т-клеток (CD45+CD3+CD11b/c—) составляет около 35 % (15 % от общего количества). Около трети этих клеток имеют фенотип T-хелперов CD45+CD3+CD4+CD11b/c— (около 13 % лимфоцитов ПП или 5.7 % от общего количества клеток ПП). Треть CD3+ клеток несёт рецептор NKR (т.н. NKT клетки). Оставшаяся часть Т-клеток нами не типирована и предположительно включает супрессорные CD8+ клетки. Около 16 % перитонеальных лимфоцитов представлены клетками, несущими рецептор NK (CD161). Три четверти из них несут Т-клеточный маркер CD3, остальные CD3-NKR+ это естественные киллеры (4% от общего числа клеток ПП).
При выделении клеток перитонеальной полости смывом стерильным раствором без предварительного привлечения клеток инъекцией тиогликолята или пептонного бульона маркер активации CD80 выявляется у менее 1 % лимфоцитов перитонеальной полости и менее чем в 3-3.5 % случаев у макрофагов и тучных клеток. Моноциты в такой популяции не выявляются.
Т.о. охарактеризованная популяция клеток перитонеальной полости является резидентной и состоит из непривлечённых клеток и преимущественно из неактивированных. Субпопуляционный состав в значительной степени отличается от периферической крови крыс и имеет видовые особенности. Полученная таким образзом популяция клеток может быть использована для проведения модельных экспериментов in vitro, a также для изучения состояния популяции тканевых фагоцитов ex vivo после воздействия радиационного фактора на целостный организм.
СПИСОК ИСПОЛЬЗОВАННЫХ ИСТОЧНИКОВ:
- Zhang, X., R. Goncalves, and D.M. Mosser, The isolation and characterization of murine macrophages. Curr Protoc Immunol, 2008. Chapter 14: p. Unit 14 1.
- Петренёв Д.Р. and К. Е.Ф., Активация системы мононуклеарных фагоцитов в отдалённые сроки после воздействия ионизирующего излучения Новости медико-биологических наук (News Of Biomedical Sciences), 2011. 3(1): p. 96-101.
- Петренёв Д.Р. and Н. А.Д., Опосредованые механизмы реализации эффектов ионизирующих излучений, in Современные проблемы биохимии. Учебное пособие для студентов и магистрантов высших учебных заведений по биологическим специальностям (Мин. Обр. РБ). Витебск. – (383 стр.), П.р.А.П.С.и.А.А. Чиркина, Editor. 2010, Изд. УО «ВГУ им. П.М. Машерова»: Витебск. p. 214-231.
- Петренёв, Д.Р., Реакции перитонеальных макрофагов крыс на продолжительное воздействие переменного магнитного поля низкой частоты 50 Гц. Известия ГГУ Серия: Естественные науки, 2015. 6(93): p. 147-149.
- Петренёв Д.Р., Изменения в окислительном метаболизме перитонеальных макрофагов у молодых крыс при длительном воздействии излучения сотовых телефонов стандарта GSM 900 Mhz. «ВЕСНІК Магілёўскага Дзяржаўнага універсітэта імя А.А.Куляшова», Серия B. ЕСТЕСТВЕННЫЕ НАУКИ (математика, физика, биология), 2010(2 (36)): p. 58-68.
- Петренёв, Д.Р.Г., А.И., Реактивность и продукция активных форм кислорода резидентными фагоцитами красного костного мозга и перитонеальной полости. Современные проблемы биохимии = Current problems in biochemistry: сб, науч. ст./ НАН Беларуси [и др.]; редкол.: Л. И. Надольник (гл. ред.) и [и др.]. — Гродно: ЮрСаПринт, 2016. 1: p. 272-277.
- Петренёв Д.Р., Электромагнитные поля и механизмы канцерогенеза Наука и Инновации, 2011. 1(59): p. 20-22
- Strauss-Ayali, D., S.M. Conrad, and D.M. Mosser, Monocyte subpopulations and their differentiation patterns during infection. J Leukoc Biol, 2007. 82(2): p. 244-52.
- Gordon, S. and P.R. Taylor, Monocyte and macrophage heterogeneity. Nat Rev Immunol, 2005. 5(12): p. 953-64.
- Ray, A. and B.N. Dittel, Isolation of mouse peritoneal cavity cells. J Vis Exp, 2010(35).

© Даниил Петренёв, старший научный сотрудник лаборатории эндокринологии и биохимии
Добавить комментарий