МАКРОФАГИ – ПЕРСПЕКТИВНАЯ МИШЕНЬ ДЛЯ РАЗРАБОТКИ НОВЫХ МЕТОДОВ ЛЕЧЕНИЯ РЯДА ТЯЖЕЛЫХ ЗАБОЛЕВАНИЙ
Более ста тридцати лет назад выдающийся русский ученый И. И. Мечников в опытах на личинках морских звезд из Мессинского пролива сделал удивительное открытие, круто изменившее не только жизнь самого будущего Нобелевского лауреата, но и перевернувшее тогдашние представления об иммунной системе – он открыл блуждающие клетки, которые назвал фагоцитами (от греч. Φάγος — пожиратель). Долгие годы считалось, что фагоциты выполняют в организме функции «войск быстрого реагирования». Однако исследования последних лет показали, что благодаря своей огромной функциональной пластичности эти клетки еще и «определяют погоду» многих метаболических, иммунологических и воспалительных процессов, как в норме, так и при патологии. Это делает фагоциты перспективной мишенью при разработке стратегии лечения ряда тяжелых заболеваний человека.
Подвижные клетки иммунной системы – фагоциты или макрофаги, присутствуют практически во всех тканях организма. Они осуществляют активный захват, переваривание и обезвреживание чужеродных микроорганизмов (вирусов, бактерий, одноклеточных, паразитов), а также утилизацию биологического «мусора», такого как «невостребованные» и погибшие клетки (например, «стареющие» эритроциты).
В зависимости от своего микроокружения тканевые макрофаги могут выполнять и различные специализированные функции. Но самым, пожалуй, удивительным свойством макрофагов оказалась их огромная пластичность, т. е. способность изменять свою транскрипционную программу («включение» тех или иных генов) и свой облик (фенотип). Следствием этой особенности является высокая разнородность клеточной популяции макрофагов, среди которых присутствуют не только «агрес¬сивные» клетки, встающие на защиту организма-хозяина; но и клетки с «полярной» функцией, отвечающие за процессы «мирного» восстанов¬ления поврежденных тканей [1].
В настоящее время макрофаги подразделяют на клетки М1, М2 и М0 типа или «классического» (провоспалительного), «альтернативного» (противовоспалительного) и неактивированного фенотипа соответственно [2]. О свойствах и функциях М1 и М2 макрофагов сообщается в ряде обзоров [3], [4].
Как отмечено выше, в ходе иммунного ответа макрофаги могут менять свой фенотип – этот процесс смены фенотипа получил название «репрограммирование».
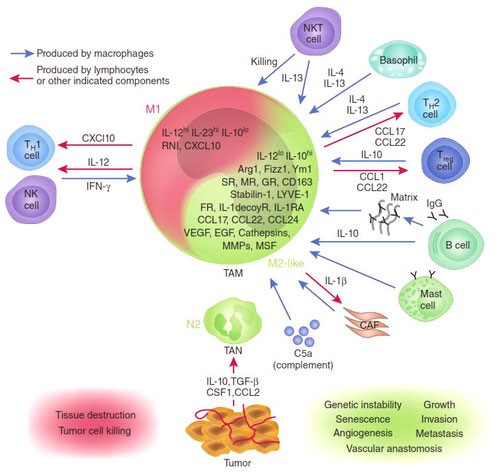
Известно, что присутствие в опухоли большого количества М1-макрофагов тормозит ее рост, а в некоторых случаях может вызвать даже практически полную ремиссию. И наоборот: М2-макрофаги выделяют молекулы — факторы роста, которые дополнительно стимулируют деление опухолевых клеток, то есть благоприятствуют развитию злокачественного образования. Экспериментально было показано, что в опухолевом окружении обычно преобладают именно М2-клетки. Под действием веществ, выделяемых опухолевыми клетками, активные М1-макрофаги «перепрограммируются» в М2-тип. Они перестают синтезировать противоопухолевые цитокины, такие как интерлейкин-12 или фактор некроза опухолей (TNF), и начинают выделять в окружающую среду молекулы, ускоряющие рост опухоли и прорастание кровеносных сосудов, которые будут обеспечивать ее питание, например фактор роста опухолей (TGFb) и фактор роста сосудов (VGF). Они перестают привлекать и инициировать другие клетки иммунной системы и начинают блокировать местный (противоопухолевый) иммунный ответ (рис.).
Ключевую роль в этом перепрограммировании играют белки семейства NF-kB [5]. Эти белки являются транскрипционными факторами, контролирующими активность множества генов, необходимых для М1 активации макрофагов. Наиболее важные представители этого семейства — р65 и р50, вместе образующие гетеродимер р65/р50, который в макрофагах активирует множество генов, связанных с острым воспалительным ответом, таких как TNF, многие интерлейкины, хемокины и цитокины. В то же время другой гомодимер семейства NF-kB — р50/р50 — обладает противоположной активностью: связываясь с теми же самыми промоторами, он блокирует их экспрессию.
И та, и другая активность NF-kB транскрипционных факторов очень важна, но еще важнее равновесие между ними. Было показано, что опухоли целенаправленно выделяют вещества, которые нарушают синтез p65 белка в макрофагах и стимулируют накопление ингибиторного комплекса р50/р50. Таким способом, опухоль превращает «агрессивные» М1-макрофаги в помощников, участвующих в ее развитии: М2-тип макрофагов, воспринимая опухоль как поврежденный участок ткани, включают программу восстановления, однако секретируемые ими факторы роста только добавляют ресурсы для роста опухоли. На этом цикл замыкается — растущая опухоль привлекает новые макрофаги, которые перепрограммируются и стимулируют ее рост вместо уничтожения.
Таким образом, в ближайшем окружении опухолей присутствует сложная смесь молекул: как активирующих, так и ингибирующих иммунный ответ. Перспективы развития опухоли (а значит, перспективы выживания организма) зависят от баланса их ингредиентов. Если будут преобладать иммуноактиваторы — значит, опухоль не справилась с задачей и будет уничтожена или ее рост сильно затормозится. Если же преобладают иммуносупрессорные молекулы — это значит, что опухоль смогла подобрать ключ и начнет быстро прогрессировать. Понимая механизмы, которые позволяют опухолям подавлять иммунитет, ученые могут разрабатывать контрмеры и сдвинуть баланс в сторону уничтожения опухолей.
Как показывают эксперименты, «перепрограммирование» макрофагов (и других клеток иммунной системы) обратимо. Поэтому одним из перспективных направлений онко-иммунологии на сегодняшний день является идея «реактивации» собственных клеток иммунной системы пациента с целью усиления эффективности других методов лечения. Для некоторых разновидностей опухолей (например, меланом) это позволяет добиться впечатляющих результатов.
Примером такого подхода служит технология, разработанная в новосибирском НИИ клинической иммунологии СО РАМН, при которой макрофаги, полученные из крови онкобольных, культивируют в присутствии стимулятора зимозана, который накапливается в клетках. Затем макрофаги вводят в опухоль, где зимозан освобождается и начинает стимулировать классическую активацию «опухолевых» макрофагов.
Сегодня становится все более очевидно, что соединения, вызывающие метаморфозы макрофагов, оказывают выраженное атеропротективное, антидиабетическое, нейропротективное действие, а также защищают ткани при аутоиммунных заболеваниях и ревматоидном артрите. За рубежом – в США, Китае, Швейцарии и Израиле уже проводятся дорогостоящие клинические испытания подобных соединений синтетического и природного происхождения. Несмотря на финансовые трудности, российские, в том числе и новосибирские, исследователи также вносят свой посильный вклад в решение этой проблемы.
Так, на кафедре химии Новосибирского государственного университета было получено безопасное соединение TS-13, стимулирующее образование М0 фагоцитов, которое обладает выраженным противовоспалительным эффектом и оказывает нейропротективное действие в экспериментальной модели болезни Паркинсона (Дюбченко и др., 2006; Зенков и др., 2009).
В Новосибирском институте органической химии им. Н. Н. Ворожцова СО РАН созданы безопасные антидиабетические и противоатеросклеротические препараты, действующие сразу на несколько факторов, благодаря которым «агрессивный» макрофаг Ml превращается в «мирный» М2 (Dikalov et al., 2011). Большой интерес вызывают и растительные препараты, получаемые из винограда, черники и других растений с помощью механохимической технологии, разработанной в Институте химии твердого тела и механохимии СО РАН (Dushkin, 2010).
Еще один пример использования макрофагов – а именно генетически модифицированных аутологичных клеток для лечения пациентов с болезнью Паркинсона предложили в Center for Nanotechnology in Drug Delivery при университете Северной Каролины.
Болезнь Паркинсона (БП) – это самое частое нейродегенеративное заболевание, от которого страдает примерно 1% всех людей, достигших 60 лет. В основе БП лежит потеря (гибель, дегенерация) дофаминергических нейронов в структуре мозга substantia nigra pars compacta (SNpс) и появление телец Леви (это агломераты белка внутри нейронов). Группа Елены Батраковой в Center for Nanotechnology in Drug Delivery занимается разработкой методов клеточного транспорта ростовых факторов и антиоксидантов в структуры мозга через поврежденный гемато-энцефалический барьер с тем, чтобы уменьшить воспаление и защитить гибнущие нейроны. Для этой цели они берут (пока у животных) макрофаги и при помощи лентивирусного вектора вводят им ген, кодирующий ростовой фактор, обычно вырабатываемый глиальными клетками.
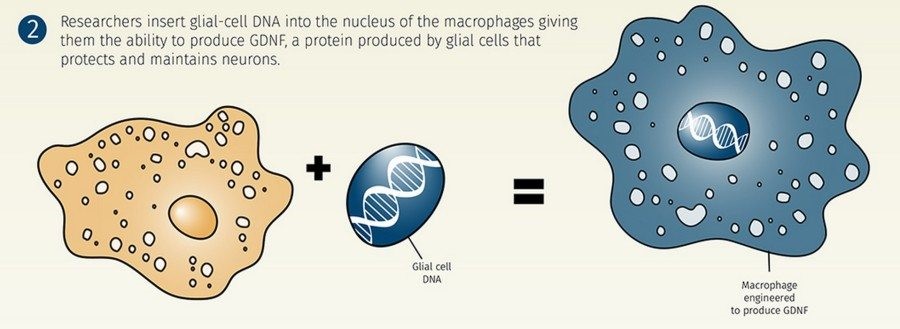
Этот фактор называется glial-derived neurotropic factor или GDNF. Известно, что GDNF уменьшает воспаление и улучшает способность нейронов выживать в тяжелой ситуации, в частности способствует восстановлению утраченных нервными клетками аксонов.
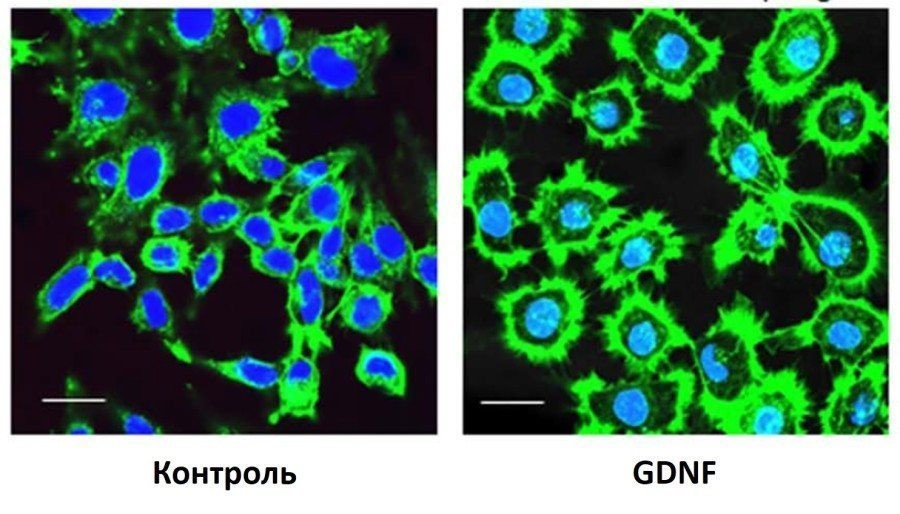
Так, на этой фотографии показано, как добавление GDNF в культуру нейронов стимулирует рост аксонов нервных клеток – зеленые ниточки, расходящиеся от тел нейронов.
Почему исследователи выбрали макрофаги? Эти клетки обладают хорошей способностью активно двигаться в сторону очага воспаления и проникать сквозь тканевые барьеры. Генетически-модифицированные макрофаги вводили внутривенно мышам с моделью БП и через некоторое время изучали у них симптоматику заболевания, а также влияние макрофагов на регенерацию поврежденных нейронов.
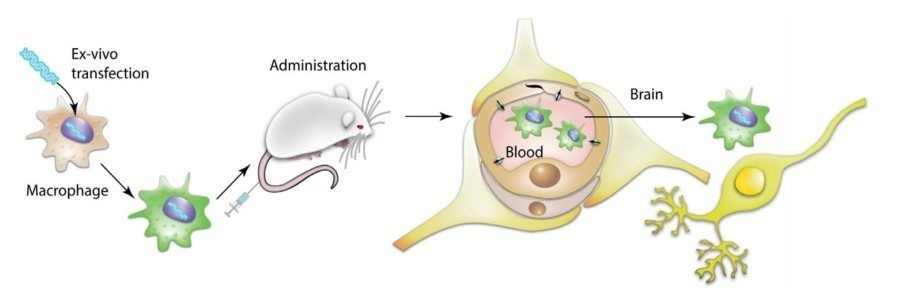
Исследования показали, что применение «заряженных» GDNF макрофагов улучшало двигательную активность и равновесие у животных с моделью БП. На тканевом уровне была показана регенерация нейронов в SNpc с одновременным снижением воспаления, оцененного по морфологии микроглиальных клеток.
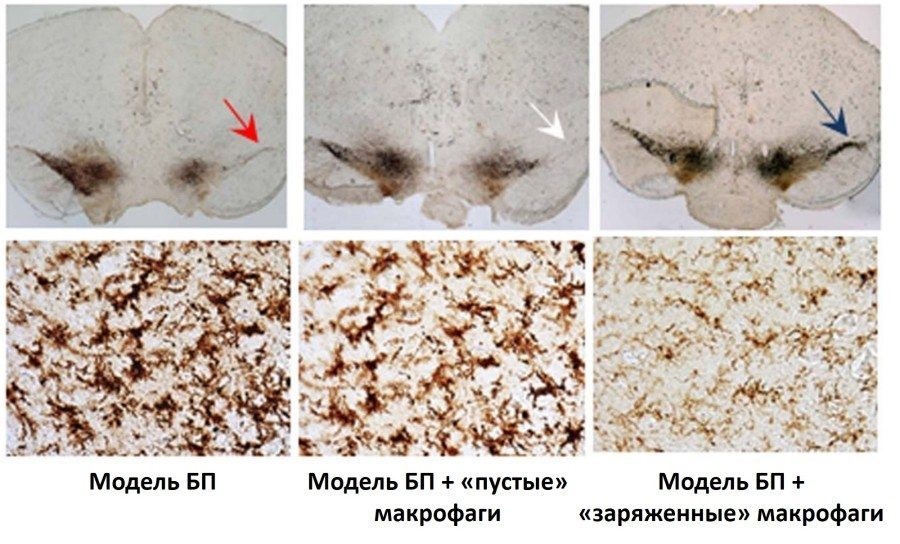
Верхний ряд картинки – это срез головного мозга экспериментальных животных. Слева – нелеченые животные с моделью БП, посередине – БП мыши, получившие «пустые» макрофаги (то есть без гена GDNF), а справа – БП мыши, получившие «заряженные» GDNF макрофаги.
Стрелкой показана регенерация нервных клеток SNpc, у животных в группе исследуемого лечения. Темная полоска – это покрашенные специальным маркером дофаминергические нейроны. На двух левых срезах они погибли, справа – живы. В нижнем ряду интенсивность коричневого маркера показывает активированные микроглиальные клетки, которые, меняют свою форму, когда чувствуют повреждение и воспаление ткани. В группе «заряженных» макрофагов микроглиальные клетки выглядят значительно «спокойнее», а воспаление слабее.
Следует добавить, что GDNF выделяется из макрофагов не «просто так», а в особых маленьких мембранных пузырьках экосомах (рис. ниже), обеспечивающих стабильность молекулы GDNF во внеклеточном пространстве и прицельное движение в сторону нейронов.
В 1996 году выяснилось, что иммунные клетки посылают друг другу экосомы, а их содержимое может влиять на регуляцию адаптивного иммунного ответа. Кроме того, оказалось, что экзосомы способны распознать «адрес», по которому их «послали». Это происходит благодаря специфическому взаимодействию адгезиновых молекул на мембранах экзосом и их клеток-мишеней. Тогда возникла идея использовать экзосомы для регуляции клеточной жизнедеятельности.
О возможности терапии с использованием трансплантации макрофагов легких для лечения легочного альвеолярного протеиноза у детей сообщается в работе [6].
Поскольку пересадка костного мозга требует предварительного подавления иммунитета, что несет риск инфекций и повышает уровень смертности, то особый интерес представляет органная терапия, специфичная к отдельным типам клеток. Поэтому в данном исследовании использовали мышей с дефицитом β-рецептора колониестимулирующего фактора макрофагов и гранулоцитов GM-CSF. У таких мышей наблюдаются те же дефекты миелоидных клеток, что и при наследственном легочном альвеолярном протеинозе у детей с мутациями генов CSF2RA и CSF2RB. Это заболевание связано с избыточным накоплением сурфактанта в альвеолах вследствие нарушения его утилизации макрофагами. Было показано, что при легочном альвеолярном протеинозе пересадка легочных макрофагов дикого типа (предварительно проверенных на предмет экспрессии необходимых маркеров и способности утилизировать сурфактант) или с мутациями гена CFS2RB без предварительной иммуносупрессии не представляет опасности и практически полностью удаляет гистопатологические эффекты заболевания. Одно введение этих клеток принесло облегчение при вторичных системных проявлениях заболевания, устранив характерную полицитемию. Это лечение нормализовало экспрессию генов и содержание маркеров заболевания и снизило смертность, продлив среднюю продолжительность жизни больных мышей на 107 дней. Популяция альвеолярных макрофагов, полученных при пересадке, сохранялась в течение одного года, и все это время продолжали проявляться терапевтические эффекты. При этом макрофаги дикого типа проявили более высокую выживаемость и интенсивность пролиферации in vitro по сравнению с макрофагами с мутантным CFS2RB. При трансплантации они более эффективно накапливались у мышей с мутацией CFS2RB, нежели у животных дикого типа. Иммуногистохимическое окрашивание по маркеру пролиферации Ki67 после пересадки GFP-маркированных макрофагов мыши дикого типа к мыши с мутацией CFS2RB показало, что пересаженные клетки успешно продолжают размножаться в организме реципиента: через месяц после трансплантации доля Ki67+-клеток составляла в среднем 32,2%. Через год средний показатель снизился до 11,29%; при этом численность макрофагов, экспрессирующих CD131 — продукт гена CFS2RB — слабо различалась у дикого типа и мутантных мышей-реципиентов. Это позволяет предположить, что пересаженные макрофаги дикого типа способны постепенно вытеснять мутантные макрофаги.
С помощью поточной цитометрии и ПЦР было установлено, что пересаженные макрофаги локализуются в легких, преимущественно между альвеолами, и отсутствуют в крови, костном мозге и селезенке. В данном исследовании [6] объяснен механизм поддержания численности популяций альвеолярных макрофагов при трансплантации и показано значение рецептора GM-CSF для их выживаемости.
Полученные японскими учеными результаты свидетельствуют о возможности применения трансплантации макрофагов для лечения легочного альвеолярного протеиноза у детей.
Таким образом, макрофаги – перспективная мишень, которая может применяться для выработки стратегии лечения ряда тяжелых заболеваний человека. В результате фармакологических и генетических манипуляций с макрофагами появляется реальная возможность превращать эти иммунные клетки из агрессивных врагов в друзей, помогающих организму сохранить или вернуть здоровье.
Литература
1. Душкин М. И. Макрофаг/пенистая клетка как атрибут воспаления: механизмы образования и функциональная роль // Биохимия. – 2012. – Т. 77. – С. 419-432.
2. Mosser, D.M. Exploring the full spectrum of macrophage activation / D.M. Mosser, J.P. Edwards // Nat. Rev. Immunol. – 2008. – Vol. 8. – P. 958–969.
3. Murray, P.J. Protective and pathogenic functions of macrophage subsets / P.J. Murray, T.A. Wynn // Nat. Rev. Immunol. – 2011. – Vol. 11. – P. 723–737.
4. Малышев, Ю.И. Матричное репрограммирование иммунных клеток и роль его нарушения в патогенезе опухолей / Ю.И. Малышев //Вестник РОНЦ им. Н.Н. Блохина РАМН. – 2012. – Т. 23. – № 2. – С. 21–33.
5. Biswas, S.K. Macrophage plasticity and interaction with lymphocyte subsets: cancer as a paradigm / S.K. Biswas, A. Mantovani // Nat. Immunol. – 2010. – Vol.11. – P. 889–8967.
6. Pulmonary macrophage transplantation therapy /Takuji Suzuki [et al.] // Nature – 2014. – Vol. 514. – N 7523. – P. 453–470.
В статье использованы материалы сайта slipups.ru

© Елена Кадукова, старший научный сотрудник лаборатории комбинированных воздействий
e-mail: helena.kad@mail.ru
Добавить комментарий