Влияние микроорганизмов на доступность радионуклидов для растений
Влияние микроорганизмов на доступность почвенных радионуклидов для растений тесно связано с процессами взаимодействия радионуклидов и микроорганизмов. Выделяют два типа микробных процессов. При первом, благодаря деятельности микроорганизмов нерастворимые соединения радионуклидов переходят в растворимую фазу, тем самым увеличивая потенциальную токсичность. В другом случае, растворимые радионуклиды закрепляются бактериями и становятся недоступными для других организмов. Отношение между иммобилизацией и мобилизацией зависит от радионуклида, вида, физико-химических условий среды. Междисциплинарные исследования, комбинирующие молекулярную биологию, микробную физиологию, химию и быстро пополняющиеся данные геномики и протеомики играют существенную роль в раскрытии данных биохимических процессов [1].
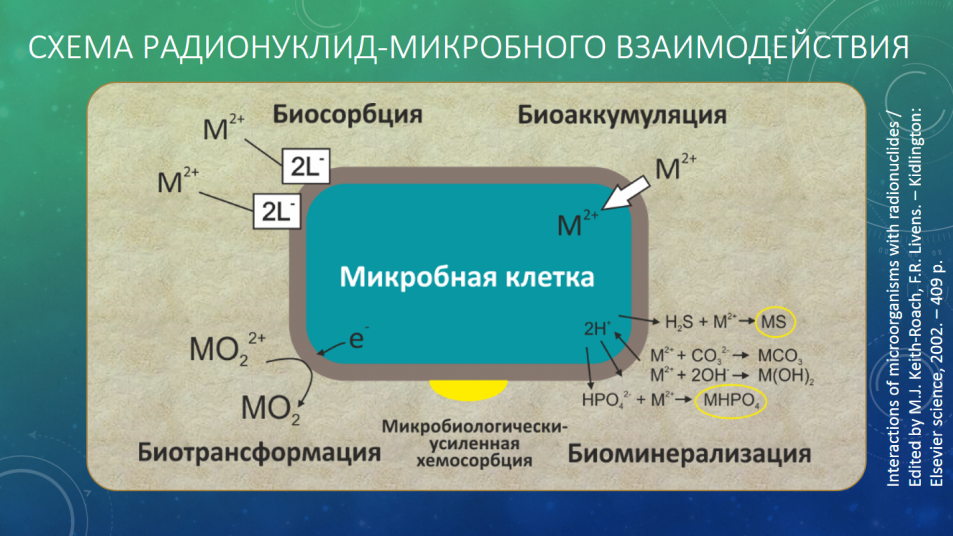
В литературе [2-4] описаны несколько механизмов взаимодействия микроорганизмов с радионуклидами: биосорбция, биоаккумулирование, биотрансформация, биоминерализация и микробиологически-усиленная хемосорбция.
Термин биосорбция используется чтобы подчеркнуть независимую от метаболизма сорбцию радионуклидов и тяжелых металлов на биомассе. Она включает в себя и адсорбцию, определяемую здесь как накопление вещества на поверхности клетки, и абсорбцию, определяемую как почти однородное проникновение атомов и молекул одной фазы, формирующей раствор, во вторую фазу. И живая и морт-масса способна к биосорбции, лиганды, включенные в соединения с металлами, содержат карбоксильные, амино-, гидроксильные, фосфатные и сульфгидрильные группы. Хорошо исследована биосорбция тория и урана. Мертвая биомасса сорбирует больше радионуклидов, чем живая. Скорее всего это связанно из-за увеличения доступных связывающих участков. Поэтому морт-масса может лучше подходить при обработке высокотоксичных радиоактивных отходов. В конечном счете, однако, количество радионуклида, остающегося в растворе в равновесии, определяется константой метал-лигандного комплекса. Единственный способ изменить состояние равновесия состоит в том, чтобы изменить форму радионуклида от плохосорбируемой к форме с более высокой близостью к лиганду. В этом контексте можно рассматривать высокий потенциал инструментов молекулярной биологии для увеличения сорбирующих свойств биосорбентов, которые получили особое внимание в последнее время. Например, созданные аминокислотные последовательности Gly-His-His-Pro-His-Gly и Gly-Cys-Gly-Cys-Pro-Cys-Gly-Cys-Gly на поверхности бактерии Escherichia coli, имеют большое количество металлсвязывающих участков. Данное стало возможным при комбинации генов, кодирующих связывающие металл участки с геном, кодирующим внешний мембранный белок LamB.
Карбоксильные группы пептидогликанов – главные связывающие участки для катионов у Грам-положительных бактерий. Важным элементом грибковых клеточных оболочек является хитин, также эффективный биосорбент для радионуклидов. Грибковые фенольные полимеры и меланины обладают многими потенциально связывающими участками с кислородсодержащими группами, включая карбоксильную группу, фенольную и другие [4].
Метаболизм-зависимая биоаккумуляция металлов и радионуклидов была изучена для наиболее физиологически важных ионов, входящих в клетку в качестве химических аналогов и использующих транспортные системы клетки. Радионуклиды в клетке могут быть изолированы богатыми цистеином металлотионинами, или, как у грибов, компартментированы в вакуолях. Здесь следует отметить, что накопление радионуклидов с большой массой, таких как актиниды, может проходить из-за увеличения проницаемости мембраны, не связанной с транспортными механизмами.
Факторы, ингибирующие клеточный энергетический метаболизм, могут прекратить биоаккумулирование и ограничить практическое применения этого способа при поглощении радиоизотопов с низкой токсичность и радиоактивностью. Другие факторы, которые могут уменьшить поглощение радионуклидов микроорганизмами, включают недостаток субстрата, анаэробиоз, и инкубацию при низких температурах в присутствии ингибиторов дыхания, таких как цианид [4, 5].
Несмотря на потенциальное ограничения метаболизм-зависимой биоаккумуляции для обработки большинства форм радиоактивных отходов, этот тип механизма потенциально полезен для обработки по крайней мере одного радионуклида – радиоцезия. Действительно, цезий-137 является хорошо изученным примером экологически релевантного радионуклида, который активно поглощается клетками микроорганизмов. Вместе с другими щелочными металлами, и в отличии от других радионуклидов, Cs+ является очень слабым акцептором электронной пары с малой способностью взаимодействовать с лигандами. Данный ион создает электростатические (ионные) слабые связи с органическими и неорганическими лигандами. Похожее поведение K+ и Cs+ показывает, что оба иона переносятся по одним транспортным системам, которые в свою очередь зависят от метаболизма микробной клетки [6].
Катлизируемая ферментами биотрансформация. Микроорганизмы могут катализировать прямое преобразование токсичных металлов и радионуклидов к меньшему количеству доступных для поглощения или образование более изменчивых форм через два ферментативных механизма. Биовосстановление может приводить к осаждению металла, в то время как биометилирование – к достаточно изменчивым продуктам. Несмотря на то, что механизмы различны, в конечном варианте происходит уменьшение концентрации поглощаемых радионуклидов [7].
Биовосстановление радионуклидов. В отсутствие кислорода, некоторые микроорганизмы способны осуществлять процесс дыхания посредством восстановления альтернативных акцепторов электронов. В этом плане долгое время признавалась экологическая уместность нитратов и сульфатов, однако современные исследования показали, что такие металлы и радионуклиды как Fe (III), Mn (IV), U (VI) могут также выполнять функцию альтернативных акцепторов электронов во время анаэробного дыхания некоторыми микроорганизмами. Большинство акцепторов электронов растворимо и может войти в микробную клетку до восстановления внутриклеточной цепью переноса электронов [4, 8].
Биоминерализация посредством произведенных микроорганизмами лигандов. Металлы и радионуклиды могут осаждаться с образуемыми ферментами микроорганизмов лигандами, такими как фосфаты, сульфиды и карбонаты. За концентрацию остаточного свободного металла в равновесии ответственно произведение растворимости комплексного соединения металла (обычно 10-20–10-30 для сульфидов и фосфатов, выше – для карбонатов). Поэтому если имеется избыток лиганда, то большая часть металлов или радионуклидов должна быть удалена из раствора. Это достаточно трудно достигнуть методами химического осаждения используя разбавленные растворы. Преимущества микробной продукции лигандов в том, что высокие концентрации лиганда достигаются на поверхности клеток, и на поверхности образуются очаги быстродействующего осаждения металлов. Фактически металлы сосредоточены против градиента концентраций.
Биоосаждение фосфатов металлов и радионуклидов через гидролиз запасенного Acinetobacre spp. зависит от чередования аэробного (синтез полифосфата) и анаэробного (гидролиз полифосфата) периодов. Этот облигатный аэроб ограничен в использовании источников углерода, но наиболее важные субстраты (ацетат и этиловый спирт) широко распространены и дешевы. Наиболее удобным микроорганизмом для биоминерализации металлов фосфатами является Citrobacter spp., который хорошо растет на дешевых доступных субстратах, а для осаждения металлов и радионуклидов жизнеспособные клетки не требуются [9].
Также в литературных источниках [10, 11] упоминается успешное осаждение сульфидов, катализируемое смешанными культурами сульфатредуцирующих бактерий, которые были использованы при обработке фильтрата почвы, загрязненной сульфатами тяжелых металлов и радионуклидами. Донором электронов для восстановления сульфата до сульфида в приведенном примере использовался этиловый спирт.
Микробиологической активности также приписывается осаждение стронций-содержащей фазы кальцита в зоне выхода грунтовых вод. Отложение минерала является результатом карбонатного осаждения цианобактериями с таким соотношением Sr/Ca, что соответствует отложению SrCO3 в кальците (до 1 % стронция).
Микробиологически-усиленная хемосорбция является общим обозначением, описывающим класс реакций, посредством которых клетки микроорганизмов изначально осаждают один металл или радионуклид в виде затравки («priming deposit»). Эта затравка действует как центр образования с последующим отложением данного радионуклида, поддерживая и ускоряя целевые реакции осаждения. Изначально затравка состоит из сульфида или фосфата, образованная по одному из пути биоминерализации [12].
В результате анализа литературных данных можем сделать вывод о том, что микроорганизмы играют важную роль в экологической судьбе радионуклидов. Они являются источниками большого разнообразия физико-химических и биологических механизмов осуществляющих превращения между растворимыми и нерастворимыми фазами. Эти механизмы – важные особенности естественных биогеохимических циклов, представляющие возможность применения их к загрязненным территориям. Несмотря на то, что биотехнологический потенциал большинства этих процессов был исследован только в лабораторных условиях, некоторые механизмы, такие как биовыщелачивание, биосорбция и осаждение используются в промышленном масштабе. Проблема перехода радионуклидов из загрязненной почвы в растения остается достаточно серьезной и по сей день. Благодаря некоторым особенностям взаимодействия почвенных микроорганизмов с радионуклидами (биосорбция, биоаккумулирование, биотрансформация, биоминерализация и микробиологически-усиленная хемосорбция) представляется возможным уменьшить биологическую доступность радионуклидов для растений.
Литература
- Geochemistry of Soil Radionuclides / Edited by P. Zhang, P.V. Brady. – Madison, 2002. – 263 p.
- Лукьянова, Е.А. Микроорганизмы глубинных хранилищ жидких радиоактивных отходов и взаимодействие их с радионуклидами: автореф. дис. на соискание уч. ст. канд. биолог. наук: 03.00.07 / Е.А. Лукьянова – Москва, – 2008. – 28 с.
- Bioremediation of radioactive waste: radionuclide-microbe interactions in laboratory and field-scale studies / J.R. Lloyd, J.C. Renshaw // Current Opinion in Biotechnology – 2005. – № 16. – P. 254–260.
- Interactions of microorganisms with radionuclides / Edited by M.J. Keith-Roach, F.R. Livens. – Kidlington: Elsevier science, 2002. – 409 p.
- Microbial dissolution and stabilization of toxic metals and radionuclides in mixed wastes / A.J. Francis // Experientia – 1990. – № 46. – P. 840–852.
- Microorganisms and Their Influence on Radionuclide Migration in Igneous Rock Environments / K. Pedersen // Journal of Nuclear and Radiochemical Sciences – 2005. – Vol. 6, № 1. – P. 11–15.
- Bioremediation: a genuine technology to remediate radionuclides from the environment / D. Prakash, P. Gabani, A.K. Chandel, Z. Ronen // Microbial biotechnology – 2013. – № 6. – P. 349–360.
- Metal and radionuclide bioremediation: issues, considerations and potentials / T. Barkay, J. Schaefer // Current Opinion in Microbiology – 2001. – № 4. – P. 318–323.
- Interactions between Metals and Bacteria: Fundamental and Applied Research / M.L. Merroun // Communicating Current Research and Educational Topics and Trends in Applied Microbiology – 2007. – P. 108–120.
- Microbial interactions with actinides and long-lived fission products / J.C. Renshaw, J.R. Lloyd, F.R. Livens // C.R. Chimie – 2007. – № 10. – P. 1–10.
- Microbial effects on mineral-radionuclide interactions and radionuclide solid-phase capture processes / D.R. Brookshaw, R.A.D. Pattrick, J.R. Lloyd, D.J. Vaughan // Mineralogical Magazine – 2012. – Vol. 76 (3). – P. 777–806.
- Microbial transformations of radionuclides and environmental restoration through bioremediation / A.J. Francis // Environmental Sciences Department – 2006. – P. 3–17.

© Руслан Спиров, младший научный сотрудник лаборатории радиоэкологии
Facebook: Руслан Спиров
Добавить комментарий