Сахар, стресс и окислительная модификация белков организма
В настоящее время признано, что окислительное повреждение различных макромолекул, составляющих структурную основу всех живых организмов (нуклеиновых кислот, белков, липидов) – это основное проявление т.н. окислительного стресса. Последний понимается как нарушение обмена веществ и энергии, накопление активных повреждающих агентов (свободных радикалов, прооксидантов и т.п.), инициирующих повреждение живых организмов на различных уровнях их организации (начиная, в первую очередь, с молекулярного) и ведущих, тем самым, к развитию различных патологических состояний. Окислительное повреждение ДНК и липидов к настоящему времени хорошо изучено, а следствия их повреждения хорошо поняты. В то же время окислительная модификация белков представляется не столь важной и значимой, и, по этой причине, гораздо менее изученной (особенно в аспекте анализа связи их окисления и функциональным состоянием организма, как-то: старение, гипероксия и гипоксия, повышение температуры, а также разного рода патологии). К настоящему времени уже достаточно четко и объемно сформировано представление об окислительной деструкции протеинов как о раннем и наиболее надежном индикаторе окислительного стресса. Поскольку белки присутствуют во всех тканях и органах, именно их модификация может выступать надежным индикатором патологических процессов как на местном (локальном), так и общеорганизменном уровне. Поскольку белки выполняют специфические функции (зачастую имеющие ясно видимое и легко фиксируемое проявление), оценка качественных и количественных аспектов окислительной модификации белков имеет ряд преимуществ. Показано, что при широком спектре патологий самой разнообразной этиологии именно окислительная модификация именно протеинов (а не липидов и нуклеиновых кислот) является одним из самых ранних и надежных маркеров их наличия и даже еще только возникновения. Кроме того, установлено, что окислительно модифицированные протеины могут находиться в живых организмах более-менее длительное время (часы, дни и даже годы (например, липофусцин)), в то время как первичные интермедиаты окислительного стресса (свободные радикалы, продукты ПОЛ) существуют в свободном состоянии гораздо менее продолжительно (обычно несколько минут, максимум несколько часов). Это обстоятельство также позволяет рассматривать феномен окислительной модификации протеинов в живых организмах в качестве относительно стабильных диагностических параметров их структурно-функционального состояния, что имеет большое значение в клинической практике. Вышеизложенное, таким образом, свидетельствует о важности места окислительной протеиновой модификации в генезе многих патологических состояний, связанных, в первую очередь, со свободно-радикальными повреждениями. В настоящее время несомненной представляется взаимосвязь между уровнем продуктов окисления белков и широким рядом функциональных состояний организмов. Так, старение, гипер- и гипоксия, повышение температуры, патологические состояния (в первую очередь, сердечно-сосудистые заболевания, ишемия/реперфузия, диабеты, нейродегенеративные состояния) четко связаны с увеличенным уровнем окислительно модифицированных белков. Однозначно утверждать, что именно модификация белков служит первопричиной отмеченных изменений сложно (точнее, что только модификация белков), но во многих случаях для этого все-таки существуют серьезные основания. Имеется достаточно примеров, когда снижение степени окисленности белков коррелировало с улучшением состояния организма. Поэтому считается, что уровень окисленных белков (и качественный характер такой окисленности) по меньшей мере может служить маркером названных изменений и, тем самым, быть полезным в деле разработки защитных мероприятий, иметь прогностическое значение при заболеваниях, использоваться для профилактики и оценки правильности и эффективности лечения.
Углеводы – важная составная часть диеты. В организме человека углеводы играют роль, которую трудно переоценить. Моносахарид глюкоза – жизненно важный углевод, необходимый для быстрого восполнения энергетических потребностей тканей, особенно головного мозга (который, кстати, потребляет до 25 % энергии, поступающей в наш организм). Такие энергетические процессы клетки, как гликолиз и митохондриальное дыхание, в результате которых образуется «энергетическая валюта» клетки – АТФ, – в большой степени зависят от доступности глюкозы. По этой причине в норме уровень глюкозы в крови строго регулируется под действием гормона инсулина. Помимо сгорания в клетке, обмен глюкозы включает в себя превращения животного крахмала – гликогена. Глюкоза может запасаться в организме в виде гликогена (обыкновенно это происходит в течение 1–2 часов после еды), либо мобилизоваться путем постепенного расщепления этого полимера и поступления в кровь (в те моменты, когда пища не поступает). Запасы гликогена сосредоточены в печени и мышцах.
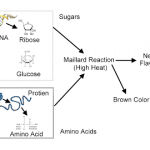
Глюкоза широко используется в важных физиологических реакциях нашего тела. Однако ее обилие делает возможной побочную химическую реакцию с белками, нарушающую их функцию. Реакция глюкозы с белками называется гликированием или неферментативным гликозилированием и представляет собой необратимое взаимодействие сахара с аминогруппами лизина и аспарагина в составе белков с образованием конечных продуктов гликирования (КПГ), перекрестных сшивок внутри белковой молекулы и между разными белками.
Результат гликирования мы можем легко наблюдать в повседневной жизни в виде коричневой корочки поджаренных продуктов. При высокой температуре белок, содержащийся в любом продукте, связывается с глюкозой, которая всегда есть в любой ткани. Точно такие же процессы «поджаривания», только более медленно, происходят с возрастом при температуре нашего тела. К сожалению, процесс этот весьма разрушительный, так как белки нашего тела могут успешно выполнять свои функции только в том случае, если имеют неповрежденную структуру. Особенно опасны и часты КПГ в почечных клубочках, сетчатке глаза и важных кровеносных сосудах, таких, как коронарные артерии, поставляющие кровь к сердцу («120 лет жизни – только начало : Как победить старение? / Алексей Москалев»: Эксмо; Москва; 2014).
 Продукты конечного гликирования (КПГ) образуются в живых организмах в результате неэнзиматических реакций углеводов (преимущественно моносахаридов) с белками (т.н. гликирование или неферментативное гликозилирование). Эти реакции представляют собой необратимое взаимодействие сахаров с аминогруппами (в первую очередь лизина и аспарагина) в составе белков с образованием КПГ, внутри- и межмолекулярных сшивок внутри белковых молекул. Результат гликирования можно легко наблюдать в повседневной жизни в виде коричневой корочки поджаренных продуктов. При высокой температуре белок, содержащийся в любом продукте, связывается с глюкозой, которая всегда есть в любой ткани. Точно такие же процессы «поджаривания», только очень медленно протекающие, происходят, в частности, по мере старения, при физиологически нормальной температуре тела человека. К сожалению, процесс этот весьма разрушительный, так как белки могут успешно выполнять свои функции только в том случае, если имеют неповрежденную структуру. Особенно опасны и часты КПГ в почечных клубочках, сетчатке глаза и важных кровеносных сосудах, таких, как коронарные артерии, поставляющие кровь к сердцу. Несмотря на то, что глюкоза в меньшей степени, чем другие углеводы (например, фруктоза и галактоза), повреждает белки в процессе гликирования, она тоже способна спонтанно переходить в форму, гликозилирующую белки. На циклическую глюкопиранозную форму глюкозы, в существующем при физиологических условиях равновесии, приходится 99,999%. И лишь крайне малая часть глюкозы представлена линейной карбонильной формой, которая и способна гликировать белки, поскольку способна спонтанно образовывать основания Шиффа с аминогруппами последних. На самом же деле из всех гексоз именно у глюкозы равновесие между циклической и карбонильной формами более всего сдвинуто в сторону циклизации. В целом гликирующая способность углеводов растёт (и значительно!) по мере снижения способности к эндоциклизации. А такая способность тем ниже, чем короче углеродный скелет молекул сахаров. Также гликирующая активность в значительной степени зависит от наличия/отсуствия фосфорилирования гидроксильного конца углевода. Исходя из этого, несложно сделать вывод о том, что наиболее активными гликирующими агентами будут являться все интермедиаты пентозофосфатного цикла и гликолиза (так, для гликолиза можно построить следующий ряд метаболитов в порядке увеличения их гликирующей активности: глюкоза, глюкозо-6-фосфат, фруктозо-6-фосфат, глицеральдегид-3-фосфат и диоксиацетонфосфат). При расщеплении глюкозы в процессе гликолиза в цитоплазме клетки также появляются промежуточные соединения (метилглиоксаль), которые в присутствии ионов меди Cu2+ гликируют белки. Конечные продукты гликирования (КПГ), связываясь с особыми рецепторами на поверхности клеток (КПГР), вызывают воспалительные реакции. Гликированные белки устраняются медленно, что на фоне общего снижения синтеза новых молекул белков вызывает серьезные проблемы со здоровьем. Гликирование вызывает атеросклероз, диабет 2-го типа, катаракту, почечную недостаточность, старческие морщины. В свою очередь, развитие сахарного диабета приводит к высокому уровню сахара в крови и тканевой жидкости и еще большему накоплению КПГ, которые являются основной причиной диабетических осложнений. Уровень гликирования не только определяет скорость старения, но и часто свидетельствует о развитии сахарного диабета. Поэтому существуют различные клинические способы выявлять и отслеживать уровень гликирования в организме. В частности, это измерение уровня автофлуоресценции кожи и количества гликированного гемоглобина (HbA1C) в крови. Вероятнее всего, в будущем этот показатель, как и некоторые другие (в частности, продукты Амадори и КПГ) войдет в число биомаркеров старения (а также диагностических маркеров различных заболеваний, включая сахарный диабет).
Продукты конечного гликирования (КПГ) образуются в живых организмах в результате неэнзиматических реакций углеводов (преимущественно моносахаридов) с белками (т.н. гликирование или неферментативное гликозилирование). Эти реакции представляют собой необратимое взаимодействие сахаров с аминогруппами (в первую очередь лизина и аспарагина) в составе белков с образованием КПГ, внутри- и межмолекулярных сшивок внутри белковых молекул. Результат гликирования можно легко наблюдать в повседневной жизни в виде коричневой корочки поджаренных продуктов. При высокой температуре белок, содержащийся в любом продукте, связывается с глюкозой, которая всегда есть в любой ткани. Точно такие же процессы «поджаривания», только очень медленно протекающие, происходят, в частности, по мере старения, при физиологически нормальной температуре тела человека. К сожалению, процесс этот весьма разрушительный, так как белки могут успешно выполнять свои функции только в том случае, если имеют неповрежденную структуру. Особенно опасны и часты КПГ в почечных клубочках, сетчатке глаза и важных кровеносных сосудах, таких, как коронарные артерии, поставляющие кровь к сердцу. Несмотря на то, что глюкоза в меньшей степени, чем другие углеводы (например, фруктоза и галактоза), повреждает белки в процессе гликирования, она тоже способна спонтанно переходить в форму, гликозилирующую белки. На циклическую глюкопиранозную форму глюкозы, в существующем при физиологических условиях равновесии, приходится 99,999%. И лишь крайне малая часть глюкозы представлена линейной карбонильной формой, которая и способна гликировать белки, поскольку способна спонтанно образовывать основания Шиффа с аминогруппами последних. На самом же деле из всех гексоз именно у глюкозы равновесие между циклической и карбонильной формами более всего сдвинуто в сторону циклизации. В целом гликирующая способность углеводов растёт (и значительно!) по мере снижения способности к эндоциклизации. А такая способность тем ниже, чем короче углеродный скелет молекул сахаров. Также гликирующая активность в значительной степени зависит от наличия/отсуствия фосфорилирования гидроксильного конца углевода. Исходя из этого, несложно сделать вывод о том, что наиболее активными гликирующими агентами будут являться все интермедиаты пентозофосфатного цикла и гликолиза (так, для гликолиза можно построить следующий ряд метаболитов в порядке увеличения их гликирующей активности: глюкоза, глюкозо-6-фосфат, фруктозо-6-фосфат, глицеральдегид-3-фосфат и диоксиацетонфосфат). При расщеплении глюкозы в процессе гликолиза в цитоплазме клетки также появляются промежуточные соединения (метилглиоксаль), которые в присутствии ионов меди Cu2+ гликируют белки. Конечные продукты гликирования (КПГ), связываясь с особыми рецепторами на поверхности клеток (КПГР), вызывают воспалительные реакции. Гликированные белки устраняются медленно, что на фоне общего снижения синтеза новых молекул белков вызывает серьезные проблемы со здоровьем. Гликирование вызывает атеросклероз, диабет 2-го типа, катаракту, почечную недостаточность, старческие морщины. В свою очередь, развитие сахарного диабета приводит к высокому уровню сахара в крови и тканевой жидкости и еще большему накоплению КПГ, которые являются основной причиной диабетических осложнений. Уровень гликирования не только определяет скорость старения, но и часто свидетельствует о развитии сахарного диабета. Поэтому существуют различные клинические способы выявлять и отслеживать уровень гликирования в организме. В частности, это измерение уровня автофлуоресценции кожи и количества гликированного гемоглобина (HbA1C) в крови. Вероятнее всего, в будущем этот показатель, как и некоторые другие (в частности, продукты Амадори и КПГ) войдет в число биомаркеров старения (а также диагностических маркеров различных заболеваний, включая сахарный диабет).
 Как уже упомянуто, другие моносахара, обладают еще большей способностью к образованию конечных продуктов гликирования, развитию диабета и атеросклероза – таковы содержащаяся в соке фруктов и меде фруктоза и получаемая с цельным молоком галактоза. Общемировое потребление фруктозы за последние 30 лет выросло на 25 %. Фруктозу стали повсеместно добавлять в продукцию пищевой промышленности, поскольку она намного слаще глюкозы и сахарозы, и в то же время она не требует инсулина для регуляции своего уровня в крови. Фруктозу активно используют как подсластитель взамен сахарозы при диабете. Она распространена в таких естественных продуктах питания, как фрукты, ягоды и мед. Наравне с глюкозой фруктоза входит в состав сахарозы. В качестве мономера фруктоза составляет полисахарид инулин – крахмалоподобное запасное вещество клубней топинамбура, корневищ цикория и одуванчика. К сожалению, фруктоза в десять раз более активно гликозилирует белки, что приводит к ускоренному старению организма. Но это не единственный её недостаток.
Как уже упомянуто, другие моносахара, обладают еще большей способностью к образованию конечных продуктов гликирования, развитию диабета и атеросклероза – таковы содержащаяся в соке фруктов и меде фруктоза и получаемая с цельным молоком галактоза. Общемировое потребление фруктозы за последние 30 лет выросло на 25 %. Фруктозу стали повсеместно добавлять в продукцию пищевой промышленности, поскольку она намного слаще глюкозы и сахарозы, и в то же время она не требует инсулина для регуляции своего уровня в крови. Фруктозу активно используют как подсластитель взамен сахарозы при диабете. Она распространена в таких естественных продуктах питания, как фрукты, ягоды и мед. Наравне с глюкозой фруктоза входит в состав сахарозы. В качестве мономера фруктоза составляет полисахарид инулин – крахмалоподобное запасное вещество клубней топинамбура, корневищ цикория и одуванчика. К сожалению, фруктоза в десять раз более активно гликозилирует белки, что приводит к ускоренному старению организма. Но это не единственный её недостаток.
В отличие от глюкозы, фруктоза не является необходимым компонентом пищи человека. Медленно всасываясь в кровь, она затем поступает в печень, где в процессе липогенеза превращается в жир, который откладывается, способствуя ожирению. Чрезмерное потребление фруктозы, как, собственно, и обилие насыщенных жирных кислот, вызывает образование атерогенных липопротеинов очень низкой плотности, приводя к сердечно-сосудистым патологиям.
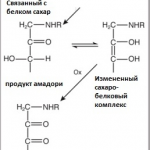 Известно, что перекисное окисление липидов (ПОЛ) усиливает гликирование белков. С другой стороны, неферментативный метаболизм глюкозы сопровождается образованием супероксидного радикала, являющегося одним из важнейших индукторов ПОЛ. Т.о. углеводный обмен (как и его стресс- и патоиндуцированные нарушения, например, метаболический синдром) и липидный обмен (равно как и его стресс- и патоиндуцированные нарушения) являются взаимосвязанными и в рассматриваемом аспекте. Тот факт, что ПОЛ активируется едва ли не при всех патологических и стрессиндуцированных процессах и может вносить существенный вклад в их развитие, породил крайне большое обилие литературы, по большей части основанной на исследованиях, где для определения ПОЛ in vivo применялись относительно простые, но и относительно не специфические методы (реакция с тиобарбитуровой кислотой и поглощение в глубокой – 230-270 нм – УФ области электромагнитного спектра, обусловленное диеновыми коньюгатами и гидроперекисями липидов), которые определяют сумму продуктов, образуемых из липидов как неферментативными, так и ферментативными (циклооксигеназный, липоксигеназный, эпоксигеназный) путями. Продукты ПОЛ являются очень активными гликирующими агентами, поскольку, в подавляющем большинстве, содержат в своём составе карбонильные группы, позволяющие им образовывать Шиффовы основания с аминогруппами. Отличительной особенностью большинства продуктов ПОЛ является высокая химическая активность, в силу чего они очень быстро неспецифично реагируют с любыми нуклеофильными группами (амино- и сульфгидрильные группы, имидазол гистидина и пр.) по механизму присоединения Михаэля с образованием оснований Шиффа. В силу этого в свободном виде такие соединения (в частности, акролеин, ацетальдегид, кротоновый альдегид, 4-гидрокси-2-ноненаль) не обнаруживаются, а регистрируются только в виде Шиффовых оснований, в частности, в составе белков (protein Schiff base), собственно и представляя собой КПГ (образующиеся из т.н. продуктов Амадори в результате одноимённой перегруппировки).
Известно, что перекисное окисление липидов (ПОЛ) усиливает гликирование белков. С другой стороны, неферментативный метаболизм глюкозы сопровождается образованием супероксидного радикала, являющегося одним из важнейших индукторов ПОЛ. Т.о. углеводный обмен (как и его стресс- и патоиндуцированные нарушения, например, метаболический синдром) и липидный обмен (равно как и его стресс- и патоиндуцированные нарушения) являются взаимосвязанными и в рассматриваемом аспекте. Тот факт, что ПОЛ активируется едва ли не при всех патологических и стрессиндуцированных процессах и может вносить существенный вклад в их развитие, породил крайне большое обилие литературы, по большей части основанной на исследованиях, где для определения ПОЛ in vivo применялись относительно простые, но и относительно не специфические методы (реакция с тиобарбитуровой кислотой и поглощение в глубокой – 230-270 нм – УФ области электромагнитного спектра, обусловленное диеновыми коньюгатами и гидроперекисями липидов), которые определяют сумму продуктов, образуемых из липидов как неферментативными, так и ферментативными (циклооксигеназный, липоксигеназный, эпоксигеназный) путями. Продукты ПОЛ являются очень активными гликирующими агентами, поскольку, в подавляющем большинстве, содержат в своём составе карбонильные группы, позволяющие им образовывать Шиффовы основания с аминогруппами. Отличительной особенностью большинства продуктов ПОЛ является высокая химическая активность, в силу чего они очень быстро неспецифично реагируют с любыми нуклеофильными группами (амино- и сульфгидрильные группы, имидазол гистидина и пр.) по механизму присоединения Михаэля с образованием оснований Шиффа. В силу этого в свободном виде такие соединения (в частности, акролеин, ацетальдегид, кротоновый альдегид, 4-гидрокси-2-ноненаль) не обнаруживаются, а регистрируются только в виде Шиффовых оснований, в частности, в составе белков (protein Schiff base), собственно и представляя собой КПГ (образующиеся из т.н. продуктов Амадори в результате одноимённой перегруппировки).
Лаборатория эндокринологии и биохимии обладает необходимым оборудованием и реактивами, что позволяет проводить на её базе полноценные исследования в области окислительного повреждения белков и других макромолекулярных компонентов, составляющих структурно-функциональную основу живых организмов.В качестве объекта исследования может выступать разнообразный перечень биологических образцов (сыворотка и плазма крови, лимфа, тканевая жидкость, слюна, тканевые биоптаты и др.).

© Александр Козлов, младший научный сотрудник лаборатории эндокринологии и биохимии
e-mail: cozlov.aleksander@yandex.ru
Александр Евгеньевич!
Очень интересная и полезная статья.
Вопрос:как снизить гликирование белков,уменьшить окислительное воздействие глюкозы но белки?
Спасибо.