Ионизирующая радиация как один из факторов развития лейкоза
Проблема онкологических заболеваний — одна из самых актуальных в современной медицине. Заболевания, объеденные в группу гемобластозов, входят в число наиболее распространенных форм опухолей. Наиболее значимая группа гемобластозов — лейкозы.
Лейкемии или лейкозы – это не одно, а целый ряд заболеваний, которые характеризуются трансформацией определенного типа кроветворных клеток в злокачественные. Раковые клетки при этом начинают размножаться и замещают нормальные клетки костного мозга и крови. Клетки костного мозга начинают мутировать, видоизменяются, нарушая производство здоровых клеток. Следствием этого процесса является развитие различных форм цитопений, снижается количество вырабатываемых клеток крови, что в итоге, приводит к их недостатку.
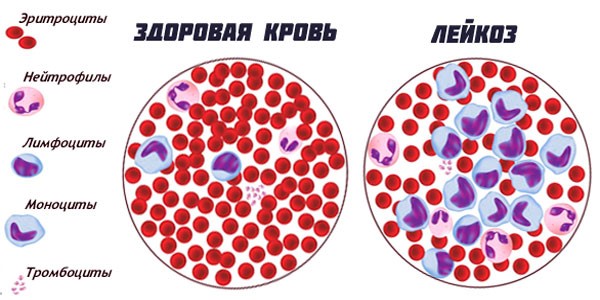
Лейкозы делят на острые и хронические. Острые лейкозы, протекающие гораздо тяжелее, чем хронические и требующие немедленного лечения, вызывает неконтролируемый рост молодых клеток крови, а при хроническом лейкозе в лимфатических узлах, селезёнке, печени и крови резко увеличивается количество более зрелых клеток [1].
В настоящее время наблюдается рост среднемировой частоты лейкозов, особенно после 1930 года и, на данный момент, она составляет около 13 случаев на 100 тыс. населения в год [2].
По данным Международного агентства по изучению рака, ионизирующее излучение является канцерогенным фактором для которого существуют достоверные сведения о канцерогенности для человека. И в частности сообщается о высоком риске развития злокачественных новообразований крови, вызванных воздействием ионизирующего излучения [2, 3]. Лейкозы могут начать отмечаться уже через 2-3 года после острого облучения [4].
Ульрих М.Д. еще в 40-х гг. XX в. отметил увеличение смертности от лейкозов среди рентгенологов. Свою роль в понимании закономерно предсказуемого, дозозависимого повышения риска лейкозов, сыграло и эпидемиологическое наблюдение жителей Нагасаки и Хиросимы, переживших атомную бомбардировку. Имеются сведения не только о повышенной частоте лейкозов у хибакуся (в 11-18 раз), но и у детей, облученных in untero, у пациентов, подвергавшихся рентгено-радиотерапии по поводу различных болезней (спондилоартрит, эритремия, тимомегалия). Были поставлены экспериментальные модели на крысах и мышах (в том числе при хроническом действии малых доз в течение не менее чем двух месяцев и при однократном облучении высокой дозой гамма-лучей – до 2 Гр и выше) [5].
В результате аварии на ЧАЭС массивному радиоактивному загрязнению подверглись большие территории Беларуси, России и Украины. В Республике Беларусь к пострадавшему в результате аварии населению было отнесено порядка 2 миллионов человек [6]. Одним из первых неблагоприятных для здоровья проявлений последствий аварии в республике прогнозировался рост онкологических заболеваний. В первые годы после аварии действительно наблюдался рост заболеваемости раком щитовидной железы и особенно в группах пострадавшего населения [7]. Однако подобного роста заболеваемости злокачественными новообразованиями крови в Беларуси отмечено не было. В структуре заболеваемости населения Беларуси злокачественными опухолями лейкозы (C91-C95) на протяжении всего послеаварийного периода составляли порядка 2-3%, как у мужчин, так и у женщин. При этом на протяжении этого периода не отмечалось значительных изменений в темпах прироста [8]. Точно также не наблюдалось выраженного всплеска заболеваемости лимфомой Ходжкина и множественной миеломой в Республике Беларусь [9, 10]. Однако по данным белорусского республиканского канцер-регистра, в республике в последние 30 лет отмечается рост заболеваемости неходжкинскими лимфомами [9, 10]. Согласно постановлению Министерства здравоохранения Республики Беларусь № 73 от 26.06.2009, острые лейкозы, хронические миелоидные лейкозы, миелодиспластические синдромы и множественная миелома относятся к заболеваниям, возникновение которых может быть связано с катастрофой на Чернобыльской АЭС в том числе и у ликвидаторов. Ликвидаторы последствий аварии на ЧАЭС во время выполнения работ получили значительные дозы радиационного облучения и могут быть отнесены к группам высокого радиационного риска [6].
После аварии на ЧАЭС широкое распространение получил анализ хромосомных аберраций в лимфоцитах периферической крови. Он же использовался и для подтверждения радиационной природы лейкозов. При исследованиях, выполненных вскоре после аварии, было выявлено повышение уровня хромосомных аберраций у жителей районов, находящихся недалеко от места катастрофы. В частности, более чем у половины жителей Гомельской области и Гомеля был обнаружен высокий уровень хромосомных аберраций (ацентрические кольца, хроматидный фрагмент, дицентрики без фрагментов, и др.) [11]. Также получены доказательства повышения заболеваемости и смертности от злокачественных опухолей и лейкозов у подвергшихся хроническому облучению жителей прибрежных сел р. Теча [12]. У ряда облученных лиц сохраняется повышенный уровень хромосомных аберраций стабильного и нестабильного типов, и соматических мутаций в гене Т-клеточного рецептора [13].
Для возникновения лучевого лейкоза необходим определенный срок (латентный период), который зависит от дозы облучения. Повышенная опасность развития лейкоза у людей наблюдается в период 4-10 лет после облучения. Так, пик заболеваемости наблюдали в городах Хиросима и Нагасаки через 6-10 лет после атомного взрыва [11]. Лейкозы, в особенности лейкозы у детей, имеют наиболее высокие коэффициенты радиационного риска и наименьшие латентные периоды.
Облучение жителей Нагасаки и Хиросимы имело характер острого воздействия (длилось на протяжении несколько секунд) и отличалось от облучения населения Беларуси, подвергающегося хроническому облучению на протяжении многих лет малыми дозами из-за аварии на ЧАЭС. При сравнении данных[14, 15] видно, что радиационные риски лейкозов у детей Беларуси превышают в несколько раз радиационные риски у жителей Хиросимы и Нагасаки, облученных в детском возрасте.
На сегодняшний день заболеваемость лейкозами относятся к наиболее обсуждаемым радиационно-эпидемиологическим проблемам оценки воздействия чернобыльской аварии на состояние здоровья населения загрязнённых территорий и ликвидаторов [16]. В то же время проведенный анализ литературных источников не показал достаточного количества публикаций, характеризующих риск развития злокачественных новообразований крови у ликвидаторов в Республике Беларусь в разрезе влияния целого ряда факторов, связанных с нахождением в зоне радиоактивного загрязнения.
ЛИТЕРАТУРА
- Воробьев А.И. Руководство по гематологии / А.И Воробьев. — М.: Медицина, 2002. — 462с.
- IARC Monographs on the Evaluation of Carcinogenic Risks to Humans– Lyon: IARC, 2012. – Vol. 100D. – 363 p.
- Ionizing radiation, part 1: x- and gamma (γ)-radiation, and neutrons. IARC Monographs on the Evaluation of Carcinogenic Risks to Humans– Lyon: IARC, 2000. – Vol. 75. – 492 p.
- Биологические эффекты при облучении в малых дозах. Источники и эффекты ионизирующего излучения. Отчет НКАДАР 2000 г. Генеральной Ассамблее ООН с научными приложениями. – Т.2: Эффекты (Ч.3) / Пер. с англ. – М.: РАДЭКОН, 2000. – С.215.
- Зайчик А.Ш. Механизмы развития болезней и синдромов / А.Ш. Зайчик, А.П.Чурилов // СПб. — 2002. — С507.
- 30 лет чернобыльской аварии: итоги и перспективы преодоления ее последствий. Национальный доклад Республики Беларусь. Минск: Министерство по чрезвычайным ситуациям Республики Беларусь. 2016. – 116 с.
- Океанов, А.Е. Заболеваемость раком щитовидной железы в Республике Беларусь/А.Е.Океанов,Е.П. Демидчик, М.А. Анкудович\\ Радиация и риск – 1995. — №6. — С. 236–239.
- Чешик, А.А. Заболеваемость лейкозами в Республике Беларусь / А.А. Чешик, И.В. Веялкин, А.В. Рожко \\ Медико-биологические проблемы жизнедеятельности — 2016. — №2 (16). — С. 62–69
- Эпидемиология злокачественных новообразований в Беларуси / И. В. Залуцкий [и др.]. – Минск: Зорныверасень, 2006. – 204 с.
- Океанов, А.Е. Статистика онкологических заболеваний в Республике Беларусь (2004-2013)/ А.Е. Океанов, П.И. Моисеев, Л.Ф. Левин;под ред. О.Г. Суконко. – Минск: РНПЦ ОМР им. Н.Н. Александрова, 2014. – 382 с.
- Абдулкадыров К.М. Хронический миелолейкоз / К.М. Абдулкадыров, С.С. Бессмельцев, О.А. Рукавицын // СПб. — 1998. – С.462.
- Аклеев А.В. Медико-биологические эффекты хронического воздействия ионизирующей радиации на человека / А.В. Аклеев, Л.Ю. Крестинина // Медицинская наука и образование Урала. — — Т9, №2. – С.8-10.
- Akleyev, A. V. Biologycal markers of radiation exposure and effects in chronically exposed peresons / A. V. Akleyev, T. A. Varfolomeyeva, A. V. Vozilova, G. A. Veremeyeva, R. G. Degtyayova, // — 2002. — 26 — P. 176-185.
- Preston, D.l, Сancer incidence in Atomic Bomb Survivors. Part III: Leukemia, Lymphoma and Multiple Myeloma / D.l. Preston, Sh. Kusumi, M. Tomonaga et al. // Radiat. Res. – 1994. – 137. — P. 68-97.
- Иванов Е.П. Гематологические эффекты малых доз ионизирующей радиации / Е.П. Иванов, М.В. Малько, Т.И. Терехович, В.Е Иванов // Радиация и экосистемы. – 2008. – С.207-211.
- Заключение РНКРЗ по докладу М.А. Максютова «основные результаты анализа медицинских радиологических последствий чернобыльской катастрофы по данным национального радиационно-эпидемиологического регистра, накопленным за 30 лет после аварии на чернобыльской АЭС» // Радиация и риск (бюллетень национального радиационно-эпидемиологического регистра). — 2016 — 25,№1 — С.13-15.
© Ксения Фабушева, младший научный сотрудник лаборатории экспериментальных биологических моделей
Добавить комментарий