Ядрышки – компонент ядра эукариотической клетки
Ядрышки – обязательный компонент ядра эукариотической клетки. Они наблюдаются в ядрах практически всех клеток, но это правило имеет небольшое количество исключений, которые лишь подчеркивают роль ядрышка в жизненном цикле клетки. К таким исключениям относятся клетки яиц, на стадии дробления, здесь ядрышки отсутствуют на ранних этапах эмбриогенеза, и клетки, которые проходят специализацию, как, например, некоторые клетки крови.
Впервые ядрышки были описаны в конце XIX столетия, когда в научных исследованиях стали активно использоваться разнообразные методы окраски ядра. Настоящий прогресс в этом направлении был достигнут при разработке и использовании в цитологии специальных ядрышковых красителей и методов, связанных с применением азотнокислого серебра [1, 2]. В шестидесятых годах прошлого столетия было показано, что ядрышко является основным местом биогенеза рибосом. С этого времени ядрышки стали объектом многих исследований.
В клеточном цикле ядрышки, присутствуют в течение всей интерфазы; в период митоза, в профазе, во время компактизации хромосом, они постепенно исчезают. В метафазе и анафазе ядрышки отсутствуют. Первые признаки новых ядрышек появляются после стадии средней телофазы, когда уже достаточно разрыхлились хромосомы дочерних ядер. В это время близ хромосом, которые деконденсируются, появляются плотные тельца – первичные ядрышки [3]. Обычно, их количество больше, чем в интерфазе. Позднее, в G1-периоде клеточного цикла первичные ядрышки растут, начинают объединяться одно за другим, их общее количество уменьшается, но возрастает объем. Общий объем ядрышка увеличивается вдвое в S- G2- периодах клеточного цикла [4].
Образование ядрышек топографически связано с определенными зонами на ядрышкообразующих хромосомах. Эти зоны называются ядрышковыми организаторами, или ядрышкообразующими районами (ЯОР) хромосом, которые локализованы в области вторичных перетяжек хромосом. В интерфазных ядрах в структуре ядрышка выделяют следующие составляющие: фибриллярные центры, плотный фибриллярный и гранулярный компоненты, ядрышковые вакуоли, и ассоциированный с ядрышком хроматин [4, 5]. Фибриллярные центры окружены плотными фибриллярными и гранулярными компонентами и содержат расплетенную рДНК и рассматриваются как интерфазные “двойники” митотических ЯОР [6]. Исследования последних лет показали, что число и размеры фибриллярных центров существенно варьирует в клетках, и зависит от их (клеток) функционального состояния, в частности, от интенсивности транскрипции рДНК [5, 7]. Что касается гранулярного компонента ядрышка, то принята точка зрения, что он, прежде всего, представлен дозревающими прерибосомами [4, 5]. В состав ядрышка входят также ферменты: РНК-полимераза-1, РНК-метилаза, топоизомераза-1; ядрышковые протеины, наиболее изученными из которых являются нуклеолин, протеины Р80 и Р105, и фосфопротеины С23 и Р100, все они локализуются преимущественно в зоне фибриллярного центра [4, 7]. На протяжении последних лет в ядрышках идентифицировано более чем 400 белков. Исследования молекулярного строения и содержимого ядрышек продолжаются сегодня и помогают понять широкий спектр ядрышковых функций.
Ядрышко представляет собой комплекс амплифицированных генов рРНК и продуктов – предшественников рибосом, и является источником основной массы цитоплазматической РНК, представленной, главным образом, рибосомной РНК.
Структурная организация ядрышка тесно связана с его функциональной активностью, и зависит от интенсивности транскрипции рДНК, скорости процессинга и выхода зрелых субъединиц рибосом из ядрышка в нуклеоплазму [4]. Поэтому, когда транскрипция и/или обработка рРНК замедлены, ядрышко частично, или полностью теряет структурную целостность. Когда транскрипция блокирована, отмечают сегрегацию ядрышковых компонентов [8]. Когда обработка и созревание рРНК ослаблены, но транскрипция рДНК все еще активна, т.е. когда утрачена связь между транскрипцией рДНК и обработкой рРНК, наблюдают рассеивание ядрышек по всей кариоплазме.
Лабильность морфологических показателей ядрышка (числа, формы, размера, микроскопического строения) считают одним из основных его функциональных свойств [4, 5]. Изменчивость морфологических и химических свойств ядрышек определяется основной их функцией – синтезом клеточной РНК, которая была отмечена Т. Касперсоном [2]. Им было показано, что количество РНК и белка в цитоплазме зависит от объема ядрышка и концентрации в нем РНК. Этот вывод позволяет связать изменения морфологических параметров ядрышек с метаболическими особенностями синтеза РНК и белка в клетке. Так, клетки, которые синтезируют большое количество белка, имеют большое ядрышко или много ядрышек [1, 6]. В малоактивных клетках ядрышко маленькое или его вообще тяжело обнаружить. При обычной функциональной нагрузке, которая отвечает нуждам определенной популяции клеток, структура ядрышка остается практически неизменной. Но в ходе клеточного цикла, в процессе дифференцирования и дедифференцирования, при угнетении или активации синтеза рРНК происходят значительные перестройки ядрышка [4].
Согласно литературным данным количество ядрышек в клетке может изменяться, но их число зависит от генного баланса клетки. Он определяется числом ядрышковых организаторов и увеличивается согласно плоидности ядра [1, 7]. Чаще всего в клетках количество ядрышек меньше, чем число ядрышковых организаторов. Это связано с тем, что при новообразовании они могут сливаться одно с другим, таким образом, в образовании одного ядрышка принимают участие несколько ядрышкообразующих районов (ЯОР) хромосом.
Ряд авторов [8-10,] считает, что увеличение количества ядрышек свидетельствует об амплификации рибосомной ДНК, а некоторые утверждают, что количество ядрышек может быть критерием дифференцирования клетки. Отмечена значительная корреляция между общим объемом ядрышек в клетках и их митотической активностью. При угнетении синтеза рРНК значительно снижается количество ядрышек на клетку, а сами ядрышки резко уменьшаются в размере и уплотняются. Подобную реакцию наблюдают, как при действии на клетки разных ингибиторов синтеза рРНК, так и в процессе естественной инактивации рыбосомных генов [9-11].
Чаще всего для визуализации ядрышек используется методика Ховела и Блэка [12] – она отличается от других применением коллоида желатина, который выступает в качестве стабилизатора и катализатора реакции, которая проходит в слабокислой среде. Разработаны многочисленные модификации данного метода, позволяющие использовать его при исследовании клеток и тканей, разнообразных организмов [13].
Экспериментальные исследования показали, что реакция серебрения базируется на выборочном связывании нитрата серебра с негистоновыми белками хромосом, которые образуют рибонуклеопротеиновые комплексы из только что синтезированной рРНК. Считают, что в ходе реакции происходит восстановление ионов Ag+ до металлического серебра, однако при этом нет единой точки зрения относительно того, какие компоненты белков осуществляют процесс восстановления ионов. Наибольшую родственность к серебру проявляют сульфгидрильные и карбоксильные группы [14]. Есть мнение, что взаимодействие с серебром может осуществляться за счет фосфатных групп, которые связаны с серином и треонином в фосфорилированных белках [13].
При окраске препаратов интерфазных клеток методом Ховела и Блека, ядрышковые организаторы видны в виде черных точек (гранул) на желтом фоне ядер или слабоокрашенных хромосом. Сами ядрышки в интерфазных ядрах окрашиваются в коричневый цвет. Специфичность окраски достигается лишь при соблюдении определенных условий (рН, температуры, времени окрашивания и концентрации AgNO3). В связи с тем, что родственность к серебру проявляют практически все компоненты хроматина, изменение условий проведения реакции ведет к выявлению, кроме ЯОР, других структур. Так, при более продолжительном крашении азотнокислым серебром проявляются центромеры хромосом и центриоли [15].
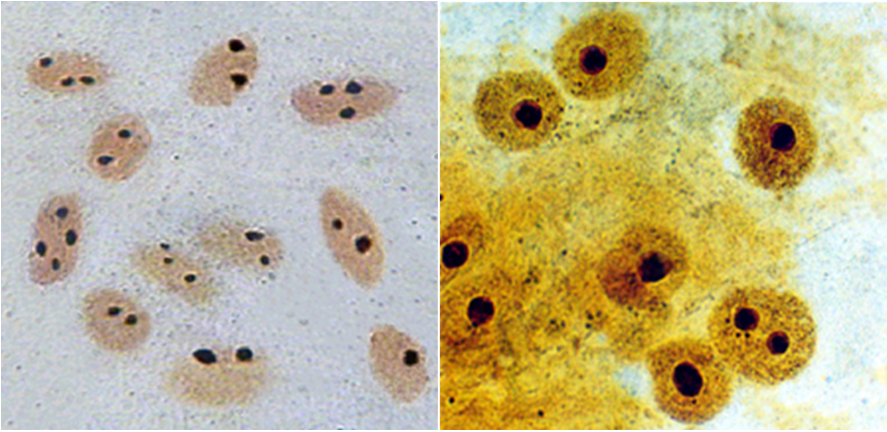
Нитратом серебра окрашиваются лишь те ядрышковые организаторы, которые в данный момент активно функционируют [14, 15]. Поэтому данный метод не только позволяет выявить ЯОР, но и дает возможность оценить функциональное состояние рыбосомных генов в клетке.
Степень аргентофильности ядрышек тесно связана с пролиферативным потенциалом клеток и уровнем их дифференцирования. Это дает возможность использовать явление аргентофильности ядрышек для изучения роста, дифференцирования и других клеточных процессов, при которых происходит изменение функционального состояния клетки, опосредствованное вариацией функциональной активности рыбосомных генов [13]. Вывод о том, что азотнокислым серебром окрашиваются лишь активные ЯОР, получил подтверждение в экспериментах по искусственному усилению и угнетению синтеза рРНК, эмбриогенеза у мышей и птиц, гаметогенеза у млекопитающих, в том числе и человека [14]. С помощью иммуноцитогенетических методов показано, что интерфазные ядрышки и хромосомные ЯОР млекопитающих, которые окрашиваются серебром, прямо отражают транскрипционную активность генов рРНК [15]. Показано, что способность определенного сайта данной хромосомы окрашиваться серебром постоянна у данного индивидуума, но существуют индивидуальные вариации в числе и распределении ЯОР, что заметно при крашении азотнокислым серебром. Установлено, что способность данного сайта окрашиваться серебром или, другими словами, способность данной хромосомы образовывать ядрышко передается наследственно. В связи с этим метод окраски азотнокислым серебром успешно применяют в кариосистематике.
Имеется много работ посвященных изучению изменения ядрышковых характеристик растительных и животных организмов в разных условиях, при влиянии естественных и антропогенных факторов [16].
Показано изменение структуры ядрышек под воздействием цитостатических препаратов в культуре клеток и в экспериментах на лабораторных животных [18]. Авторы отмечают, что данные эффекты характерны для агентов, которые угнетают транскрипцию и процессинг рРНК, блокируют обособление прерыбосом от ядрышка.
Показано увеличение объема ядрышкового материала в клетках растений при воздействии неблагоприятных экологических условий [19]. Более высокую активность ядрышкового аппарата в условиях естественной и антропогенной нагрузок связывают с действием адаптивных механизмов в условиях экстремальности, вызванной природными и антропогенными факторами.
Отмечено влияние малых доз ионизирующей радиации на ядрышковый аппарат зародышей карпа [20]. Показано стимулирующее свойство низких концентраций некоторых мутагенных факторов на гонады рыб и ооциты млекопитающих, следствием, которого является образование большого количества дополнительных ядрышек и усиление биосинтеза белка [21].
При исследовании влияния растворов солей кадмия и хрома на клетки жабр и гепатоцитов рыб Odontesthes bonariensis, показано значительное изменение объема ядрышек в этих клетках в зависимости от концентрации тяжелых металлов [22]. В экспериментах по влиянию растворов кадмия на клетки представителя миксомицет, Physarum polycephalum, отмечено изменение структуры ядрышка, описана его сегрегация, появление множественных ядрышкоподобных телец в ядре и образование кольцевидного ядрышка, при этом наблюдалось значительное снижение синтеза РНК [23]. Подобные изменения наблюдались и при влиянии кадмия на клетки корневой меристемы лука [24]
Приведенный выше обзор, позволяет заключить, что ядрышко – это обязательная структура ядра интерфазной клетки, оно занимает одно из центральных мест в синтезе белка клеткой, и отображает как уровень биосинтетической активности клетки на разных стадиях клеточного цикла, так и функциональное состояние клетки в нормальных условиях и в условиях патологии, или влияния токсичных веществ и других факторов.
Литература:
- Shaw P.J. The nucleolus / J.Shaw, E.G. Jordan // Annu. Rev. Cell Dev. Biol. – 1995. – N 11. – P. 93-121.
- Caspersson T.O. Cell growth and cell function / Caspersson T.O. – W. W. Norton and Co. Inc. New York, 1950. – 185 p.
- Dundr M., Misteli T., Olson M. The Dynamics of Postmitotic Reassembly of the Nucleolus // The Journal of Cell Biology. – 2000. — V. 150, N 3. – P. 433-446.
- Hernandez-Verdun D. Nucleolus: from structure to dynamics / Hernandez-Verdun // Histochemistry and Cell Biology. – 2006. – V. 125. – Р.127-137.
- Leger-Silvestre I. The Nucleolar UltrastructureIn Yeast / Leger-Silvestre, N. Gas // Olson, M.O.J. (Ed.). The Nucleolus. – Kluwer Academic / Plenum Publishers, 2004. – P. 21–28.
- The multifunctional nucleolus / M.Boisvert, S. Koningsbruggen, J. Navascues [et al.] // Nature Reviews Molecular Cell Biology. – 2007. – V.8, №7.– Р.574-585.
- Mosgöller W. Nucleolar Ultrastructure in Vertebrates // The Nucleolus / M.O.J. Olson [ed.]. — Kluwer Academic/ Plenum Publishers, – P.10–20.
- Dynamic sorting of nuclear components into distinct nucleolar caps during transcriptional inhibition /Shav-Tal, J.Blechman, X. Darzacq [et al.] // Molecular Biology of the Cell. –2005. – V. 16. – P. 2395–2413.
- Мамаев Н.Н. Структура и функция ЯОР хромосом: молекулярные, цитологические и клинические аспекты / Н.Н. Мамаев, С.Е. Мамаева // Цитология. – 1992. – Т. 34, № 10. – С. 3–26.
- Pederson T. The plurifunctional nucleolus / T. Pederson // Nucleic Acids Res. — 1998. – N 26. – P. 3871-3876.
- Ранняя экспрессия белка ядрышка SURF-6 в лимфоцитах селезенки мыши, активированных к пролиферации in vitro / А.А. Моралева, М.В.Малышева, Х. Магоулас [и др.] // Бюллетень экспериментальной биологии. — 2009. — Т. 147, № 5. — С. 507—511.
- Howell W.M. Controlled silver-staining of nucleolus organizer regions with a protective colloidal developer: a l-step method / M.Howell, D.A.Black // Experientia. – 1980. – V.36. – P. 1014–1015.
- Ochs R.L. Methods used to study structure and function of the nucleolus. / L. Ochs // Methods in Cell Biology. – 1998. – V. 53 – P. 303-321.
- “Ag-NORs” are not always true NORs: new evidence in mammals / G. Dobigny, C. Ozouf-Costaz, C. Bonillo [et al.] // Cytogenetic and Genome Research. – 2002. – V. 98. – P. 75-77.
- Сабонеева Е.В. Специфичность окрашивания ядрышковых организаторов азотнокислым серебром / Е.В. Сабонеева // Цитология. – 1989. – Т. 31, № 1. – С. 5-15.
- Котеева Н.К. Изменение структуры ядрышек клеток апикальной меристемы побега и мезофила хвои сосны обыкновенной в годичном цикле / Н.К.Котеева // Цитология. – 1999. – Т. 41, № 6. – С. 479-485.
- Reprogramming of nucleolar gene expression during the acclimatization of the carp / M.I.Vera, L. Norambuena, M. Alvarez [et al.] // Cell molecular biology Research. – 1993. –V. 39. – P. 665–674.
- Сауткина Е.Н. Состояние ядрышковых белков В23/нуклеофозмина и UBА в клетках HELa при апоптозе, индуцируемом фактором некроза опухолей / Е.Н. Сауткина, Н.А. Потапенко, Н.М. Владимирова // Биохимия. – 2006. – Т. 71, № 6. – Р. 786-797.
- Артюхов В.Г. Цитогенетический полиморфизм семенного потомства деревьев березы повислой (Betula pendula Roth), произрастающих в различных экологических условиях / В.Г. Артюхов, В.Н.Калаев, С.С. Карпова // Экологическая генетика. – 2009. – Т. 7, № 1. – С. 30 – 40.
- Архипчук В.В. Влияние малых доз радиации на ядрышковую активность эмбрионов карповых рыб / В.В. Архипчук // Радиобиология. — 1990. — Т. 30, N 4 — С. 496 -501.
- Хволес А.Г Механизм стимуляции мутагенами / А.Г. Хволес, Т.А.Черняев // Доклады АН СССР. – 1988. – Т. 301, № 4. – С. 985-988.
- Nucleolar variation in response to nutritional condition in juvenile pejerrey Odontesthes bonariensis (Valenciennes) / P. Carriquiriborde, J.C. De Luca, F.N. Dulout, A.E. Ronco// Journal of Fish Biology. – 2007. – V. 70, 3. – P. 947–958.
- Sina J.F. Cadmium Modification of Nucleolar Ultrastructure and RNA Synthesis in Physarum polycephaluml / F.Sina, B.Chin // Toxicology And Applied Pharmacology. – 1978. – N. 43. – Р. 449–459.
- Marcano L. Effect of cadmium on the nucleoli of meristematic cells of onion Allium cepa L: an ultrastructural study / Marcano // Environmental research. – 2002. – V. 88, № 1. – Р.30-35.
Фотоматериалы из личного архива автора.

© Наталия Веялкина, кандидат биологических наук, заведующая лабораторией экспериментальных биологических моделей
e-mail: veyalkina@irb.basnet.by
Добавить комментарий